Nach zehn Monaten intensiver Forschungsarbeit ist es der Biotechnologie gelungen, positive Impfstoff-Daten in klinischen Phase-3-Studien zu publizieren. Während am 9. November das Duo Pfizer/BioNtech in ihrer Studie eine Effizienz von 90 % erreichte, wartete am 16. November Moderna sogar mit 94.5 % Effizienz auf. Eine Zulassung in Amerika im Dezember ist bei beiden Kandidaten im Bereich des Möglichen, in Europa dürfte es Anfang 2021 werden.
Hohe Effizient bei den Kandidaten von Pfizer/BioNtech und Moderna
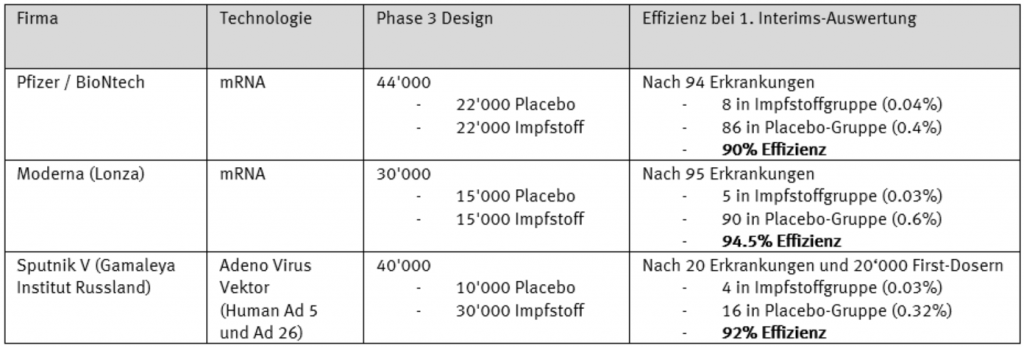
Innerhalb der Phase-3-Studie von Pfizer/BioNtech, in welcher 44‘000 Probanden (22’000 erhielten Placebo) geimpft wurden, werden 94 Erkrankungen vermerkt. Von diesen 94 erkrankten Personen stammen mindestens 86 aus der Placebo-Gruppe, das heisst, diese Personen wurden nicht mit dem richtigen Impfkandidaten geimpft und haben sich mindestens eine Woche nach der zweiten verabreichten Placebo-Dosis nachweislich mit symptomatischem SARS-CoV‑2 infiziert. So bleiben maximal acht Personen, die den Impfkandidaten verabreicht bekamen und trotzdem erkrankt sind. Setzt man diese Zahlen zueinander ins Verhältnis, bedeutet dies eine Impfstoff-Effizienz von 90%, was sehr hoch ist.
Auch Moderna konnte am 16. November 2020 die ersten Interims-Daten ihrer Phase-3-Studie publizieren. In der 30’000 Probanden umfassenden Studie wurden bis zur Auswertung 95 Erkrankungen gemeldet. 90 davon stammen aus der Placebo-Gruppe, d.h. nur fünf stammen aus der Gruppe, die wirklich geimpft wurde. Die Effizienz liegt hier sogar bei hohen 94.5 %.
Auch das russische Projekt der Gamaleya Instituts hat Interims-Daten nach 20 Erkrankungen publiziert und kommt auf 92 % Effizienz. Jedoch scheint dieses Datenset sehr frühzeitig publiziert worden zu sein, sogar bevor die Probanden die zweite Dosis erhalten haben. Daher sind wir bezüglich diesem Impfkandidaten eher zurückhaltend.
Der erste Zulassungsantrag kann sehr bald gestellt werden
Die laufenden Phase-3-Studien beider Projekte müssen nun noch die geforderten 2‑Monate an Sicherheitsdaten publizieren, bevor ein Zulassungsantrag bei der Federal Drug Administration (FDA) eingereicht werden kann. Diese Daten sollten bei Pfizer/BioNtech in der dritten Novemberwoche und bei Moderna Ende November zur Verfügung stehen. Nach einer Prüfung bei der FDA steht einer Notfall-Zulassung in Amerika bereits im Dezember nichts mehr im Weg. Eine Zulassung in Europa könnte anfangs 2021 erfolgen.
Die Federal Drug Administration (FDA) hat von den Entwicklern eine Effizienz von mindestens 50 % erwartet. Somit ist nach so kurzer Zeit das Erreichte für die Impfstoff-Entwicklung enorm positiv zu werten. Trotz all dieser zuversichtlich stimmenden Daten braucht es weitere wichtige Auswertungen, um die Dauer des Impfschutzes zu ermitteln.
Ist dies die Geburtsstunde der mRNA-Technologie?
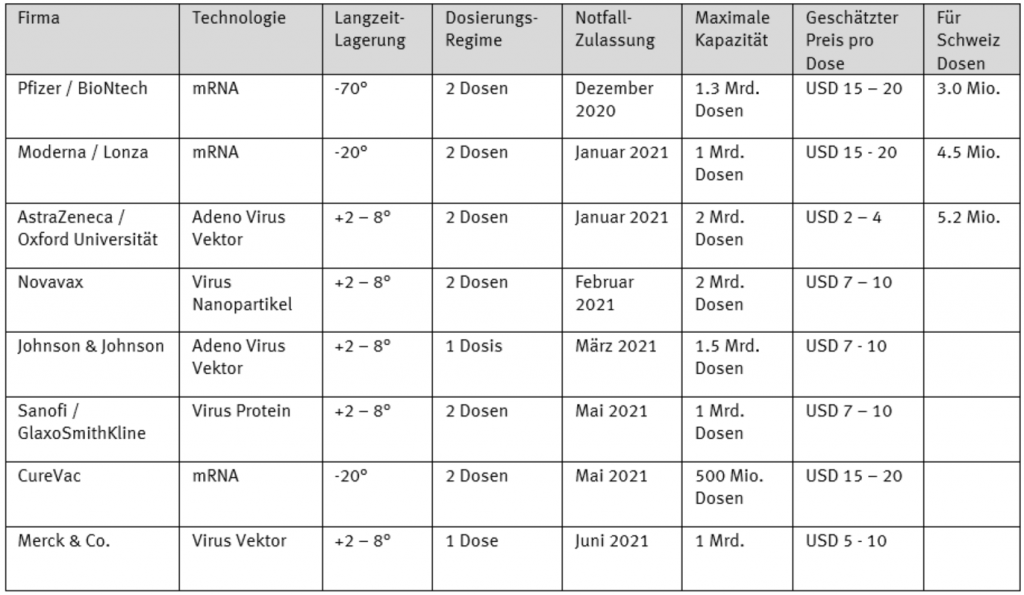
Beide Impfkandidaten basieren auf der neuartigen mRNA-Technologie (messenger RNA). Dabei wird dem menschlichen Körper eine einsträngige Kopie der DNA verabreicht, die eine Anleitung für die Produktion des Spike-Proteins des Virus enthält. Die menschlichen Zellen lesen diese Bauanleitung und stellen das identische aber ungefährliche Spike-Protein her, auf welches das Immunsystem dann die Antwort und den Schutz aufbaut. Der spannende Ansatz scheint seine Geburtstunde zu erleben. Die Herausforderung bleibt aber die Stabilität dieser Produkte. Der Pfizer/BioNtech Kandidat muss bei ‑60 bis ‑70° gelagert und transportiert werden. Er überlebt im Kühlschrank bei 2 — 8 Grad lediglich einen Tag. Dafür braucht es aufwändige Kühlketten, die mit UPS, DHL oder Va-Q-Tec aufgebaut werden. Demgegenüber scheint Moderna eine stabilere Variante hergestellt zu haben. Dieser Kandidat soll bei ‑20 Grad transportiert und gelagert und im Kühlschrank sogar rund 30 Tage überleben können. Andere Impfkandidaten, die auf anderen Technologien basieren, können teilweise noch länger im Kühlschrank gelagert werden.
Bis Ende Jahr können Pfizer und BioNtech ca. 50 Mio. Dosen des Impfstoffs fertigen. Moderna dürfte zusammen mit Lonza rund 20 Mio. Dosen herstellen können. Diese reichen für rund 35 Mio. Personen. 2021 könnten die Kapazitäten dann hochgefahren werden und Pfizer/BioNtech könnte rund 1,3 Mrd. Dosen und Moderna immerhin 500 — 1’000 Mio. Dosen produzieren.
Es braucht weitere Impfkandidaten
Bis jetzt haben bereits einige Staaten und Länder eine Vielzahl von Vorbestellungen verschiedener Impfstoffe getätigt. Die EU hat sich zum Beispiel bereits 300 Mio. Dosen des Pfizer/BioNtech Produktes gesichert. Bis diese aber die EU in vollem Umfang erreichen, werden weitere sechs bis neun Monate vergehen. In einer ersten Phase sollen damit Risikopersonen und Spitalpersonal geimpft werden.
Nach Pfizer/BioNtech und Moderna dürften AstraZeneca sowie Johnson & Johnson die nächsten Kandidaten sein. Beide befinden sich ebenfalls in der letzten klinischen Phase-3-Studie. Beide Kandidaten mussten aber mindestens einen Monat Zwangspause einschalten, da Probanden der Studien schwere Nebenwirkungen aufgewiesen haben, die aber nichts mit dem Impfkandidaten zu tun hatten. Dies hat deren Fortschritt etwas verzögert, erste Auswertungen werden frühestens Ende Dezember erwartet.
Die Kandidaten von AstraZeneca und der Oxford University sowie von Johnson&Johnson basieren beide auf Adeno Virus Vektor Technologie, bei derer ein dem Menschen bekanntes Erkältungsvirus Bauanleitungen von SARS-CoV‑2 enthält. Auch die Studiendaten von Novavax, welche dem Körper ungefährliche Virus-Nanopartikel von SARS-CoV‑2 verabreichen wollen, könnten im Januar publiziert werden. All diese Impfkandidaten liessen sich sogar bei +2 bis +8 Grad lagern.
Viele Länder sichern sich ihre Impfdosen
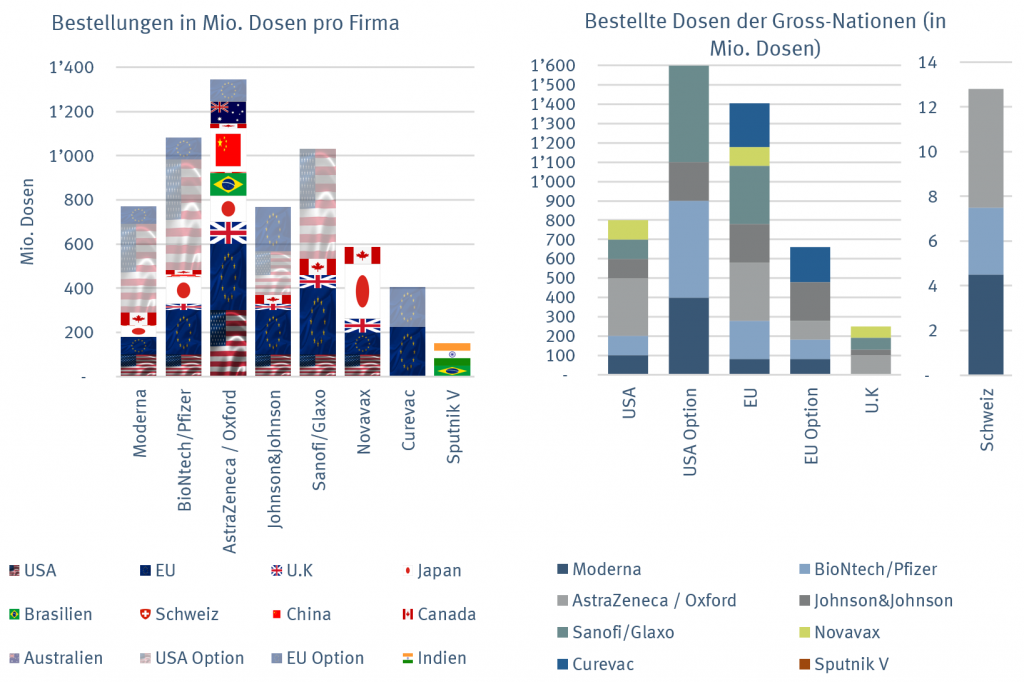
Bisher wurden weltweit über 6 Mrd. Dosen von Impfstoffen mit einem Gegenwert von über USD 60 Mrd. vorbestellt. Dies zeigt, wie dringend viele Länder wieder in eine „Normale Welt“ zurück möchten. Die Staaten und Länder haben sich mit mehreren Verträgen und über diverse Technologien abgesichert, falls einige Kandidaten die kritische 3. Phase nicht erfolgreich meistern sollten.
Die Europäische Union hat offiziell 1.4 Mrd. Impfdosen bestellt. Das reicht, um die gesamte Bevölkerung von etwas über 700 Mio. zu impfen. Hinzu kommen Options-Verträge über weitere 650 Mio. Die Vereinigten Staaten haben 800 Mio. Dosen vorbestellt, was ebenfalls den Bedarf für die ganze Bevölkerung von 330 Mio. Menschen deckt. Die Optionsverträge liegen sogar bei 1.6 Mrd. Dosen.
Auch die Schweiz bleibt nicht untätig
Die Schweiz hat Vorbestellung von 4.5 Mio. Dosen bei Moderna sowie von 5.3 Mio. bei AstraZeneca getätigt. Zudem hat unser Land das Budget für Impfstoffe um weitere CHF 100 Mio. auf 400 Mio. erhöht. Dies stellt unter anderem sicher, dass die 3 Mio. Dosen des Pfizer / BioNtech Impfstoffes reserviert werden konnten. Die Schweiz wird vermutlich ordnungsgemäss die sechs Monate Sicherheitsdaten, welche es für eine normale Zulassung braucht, abwarten und erst im 2. Quartal 2021 mit Impfen beginnen. Die Problematik mit den Kühlketten wurde in der Schweiz zusammen mit dem Militär bereits gelöst. Unser Land scheint also relativ gut gerüstet zu sein. Ziel ist es auch in der Schweiz, zuerst Risikopersonen sowie das Gesundheitspersonal zu impfen.
Abgekürztes Zulassungsverfahren
In der Schweiz stehen aktuell in der Zulassungsprüfung nach „Rolling Review“ neben AstraZeneca auch Pfizer und BioNtech sowie neu Moderna. Ein Rolling Review bedeutet, dass die Studiendaten fortlaufend von der Swissmedic getestet werden und nicht erst am Ende beim Zulassungsantrag. Dies spart natürlich deutlich Zeit.
Die Kapazitäten werden nicht sofort verfügbar sein
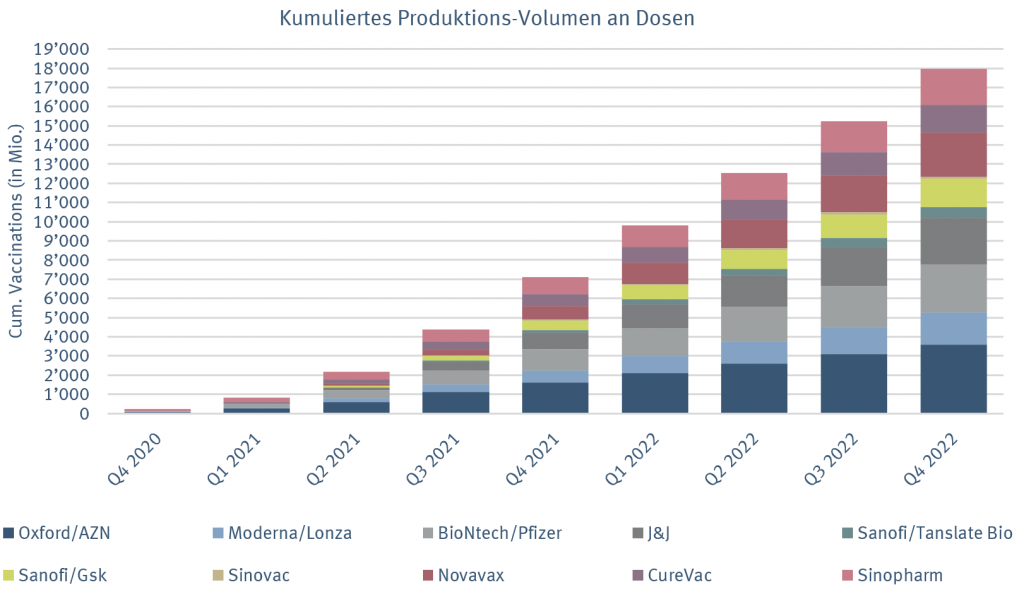
2020 werden maximal 50 bis 100 Mio. Dosen erhältlich sein. Im 1. Quartal 2021 geht man von einer Produktionserweiterung auf maximal 700 Mio. Dosen aus. Dies setzt aber voraus, dass eine Vielzahl von Impfprojekten wie zum Beispiel von Johnsons&Johnson, AstraZeneca oder Novavax ebenfalls positive Phase-3-Daten publizieren werden. Erst nach dem 2. Quartal 2022 wären insgesamt etwa 12 Mrd. Dosen produziert, so dass die gesamte Menschheit geimpft werden könnte. Es dauert also auf jeden Fall noch etwas, bis gegen COVID-19 weltweit eine Lösung verfügbar ist.
Bisher relativ gute Sicherheitsprofile
In den durchgeführten Phase‑1 und Phase-2-Studien sowie auf Basis der ersten Interims-Daten der Phase‑3 haben die Impfstoff-Kandidaten bisher relativ gute Sicherheitsprofile gezeigt. Es sind bei den meisten zwar leichte Nebenwirkungen aufgetreten, diese sind aber relativ schnell wieder abgeklungen. Bei den meisten handelte es sich um lokale Schmerzen an der Impfstelle, Kopfschmerzen, Müdigkeit oder leichtes Fieber. Moderna hat bereits detailliertere Informationen zur Phase‑3 veröffentlicht. Die Grad-3-Nebenwirkungen umfassen Schmerzen an der Injektionsstelle (2.7 %) nach der ersten Dosis und Müdigkeit (9.7 %), Muskelschmerzen (8.9%), Gelenkschmerzen (5.2 %), Kopfschmerzen (4.5 %) und Rötungen (2.0 %) nach der zweiten Dosis. Die bald folgenden 2‑Monatsdaten werden weiteren Aufschluss darüber geben.
Ganz ohne Nebenwirkungen wird kein Kandidat über die Runden kommen. Das ist aber auch bei den Influenza-Impfstoffen so. Es bleibt den Bürgerinnen und Bürger selber überlassen, ob sie kleinere Nebenwirkungen für den Schutz gegen eine Krankheit wie COVID in Kauf nehmen werden oder nicht, denn an eine allgemeine Impfpflicht ist aktuell nicht zu denken.
Offene Fragen
In den kommenden Monaten stehen die folgenden Fragen im Zentrum:
1) Wie lange hält der Schutz einer Impfung an?
2) Wie oft muss demnach geimpft werden?
3) Wie wichtig sind neutralisierende Antikörper? Oder spielen T‑Zellen in der Immunabwehr eine noch wichtigere Rolle?
4) Bleibt SARS-CoV‑2 ein Virus, welches eher langsam mutiert, so dass eine Impfung nicht jedes Jahr neu produziert werden muss?
Die Wissenschaft geht heute davon aus, dass der Impfschutz rund ein Jahr bestehen könnte, was für eine jährliche Impfung sprechen würde. Fraglich bleibt aber noch immer, ob die neutralisierenden Antikörper die wichtigsten Komponenten oder ob es doch eher die zelluläre Immunität (T‑Zellen) sind. Bei den T‑Zellen waren die Daten in den klinischen Studien der Impfstoff-Kandidaten teilweise unterschiedlich. Antworten auf diese Fragen wird man aber erst im Laufe des Jahres 2021 finden. Glücklicherweise ist die Mutationsrate des Virus bisher eher langsam, das Spike-Protein, auf das sich die Wissenschaft fokussiert hat, scheint bisher stabil zu sein.
Vorsichtiger Optimismus
Über die nächsten Monate wird uns die zweite Welle der Pandemie aber weiter beschäftigen. Eine kurzfristige Lösung bieten die positiven Impf-Studien noch nicht. Aber sie geben Hoffnung, dass die Pandemie unter Kontrolle gebracht werden kann. Ebenfalls zeigt die zweite Welle, dass das Spitalpersonal bei der Behandlung von der Erfahrung der ersten Welle profitiert. Die Krankheit wird allgemein besser verstanden und die Patienten können gezielter behandelt werden. Dies führt dazu, dass aktuell die Notfallpatienten weniger lange auf der Notfall-Station verweilen müssen und die Todesfallrate tiefer ist als noch im Frühjahr. Vorsichtiger Optimismus ist angebracht, es braucht aber auf alle Fälle noch etwas Geduld und Durchhaltevermögen.
Disclaimer:
Die Informationen und Ansichten in diesem Blog dienen ausschliesslich Informationszwecken und stellen insbesondere keine Werbung, Empfehlung, Finanzanalyse oder sonstige Beratung dar. Namentlich ist dieser weder dazu bestimmt, dem Leser eine Anlageberatung zukommen zu lassen, noch ihn bei allfälligen Investitionen oder sonstigen Transaktionen zu unterstützen. Entscheide, welche aufgrund der vorliegenden Publikation getroffen werden, erfolgen im alleinigen Risiko des Anlegers.
Bei Fragen zu diesem Thema stehen wir Ihnen gerne zur Verfügung.
notablog@rahnbodmer.ch
Weitere Beiträge von Rahn+Bodmer Co.